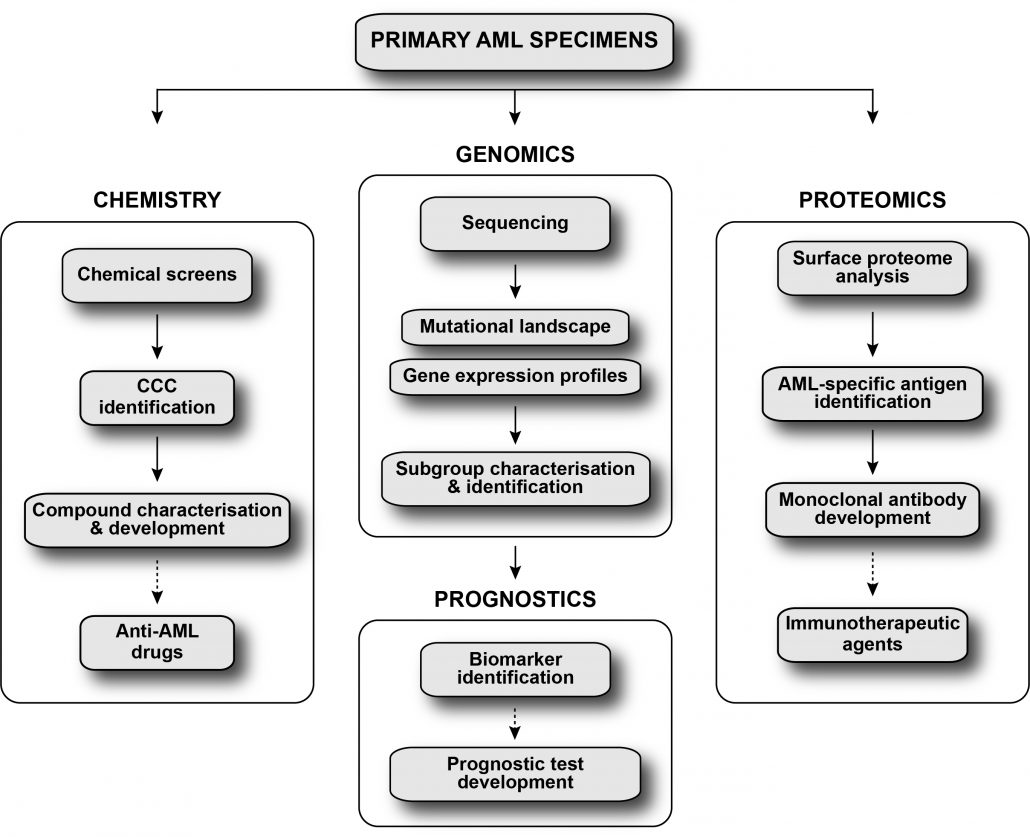
Le projet Leucégène vise à améliorer la stratification de la leucémie myéloïde aiguë et à développer de nouvelles stratégies thérapeutiques pour cette maladie en utilisant une approche intégrée.
La leucémie myéloïde aiguë (LMA) est diagnostiquée chaque année chez plus de 50 000 personnes au Canada, aux États-Unis et en Europe. La LMA est associée à une survie globale à 5 ans d’environ 27%. Cette maladie hautement mortelle se caractérise par plusieurs aberrations chromosomiques et altérations moléculaires constituant la base du modèle de risque génétique actuel stratifiant la LMA en trois catégories de risque: favorable, intermédiaire et défavorable. Ces catégories guident le choix de la thérapie de consolidation, soit la chimiothérapie pour les patients à risque favorable, et la greffe de cellules souches pour les patients à risque défavorable. Cependant, le traitement des patients entrant dans la catégorie de risque intermédiaire est problématique, car le risque de rechute est difficilement prévisible pour ces patients. Ceci a généralement pour conséquence le sur- ou sous-traitement de ces patients, entraînant de graves conséquences médicales, sociales et économiques. Il y a donc un besoin urgent d’identifier des marqueurs pronostiques précis stratifiant plus adéquatement les patients à risque intermédiaire, ainsi que de découvrir de nouvelles stratégies thérapeutiques pour le traitement de ces patients. L’approche du projet Leucégène pour améliorer cette situation est de s’appuyer sur les compétences acquises et de collaborer avec des chercheurs détenant une expertise supplémentaire en génomique fonctionnelle, chimie médicinale et protéomique, dans le but de développer de nouveaux tests pronostiques ainsi que de nouvelles stratégies thérapeutiques pour améliorer la gestion des patients atteints de LMA.
Identification de nouvelles thérapies pour la LMA
en collaboration avec le groupe d’Anne Marinier
La leucémie myéloïde aiguë est une maladie très hétérogène, elle peut donc être perçue comme plusieurs maladies différentes. Cela explique en partie la réponse imprévisible au traitement standard pour cette maladie (cytarabine + anthracycline) observée chez les patients atteints de LMA. Ce projet vise l’identification de nouvelles approches thérapeutiques pour la LMA via la découverte de médicaments ciblant spécifiquement les différents sous-types de LMA. Pour y arriver, des échantillons primaires de LMA humains sont exposés à des collections de composés chimiques dans des conditions de culture ex vivo optimisées soutenant l’activité des cellules souches leucémiques. La réponse à ces composés est organisée hiérarchiquement pour former des « grappes de corrélation de composés » ou CCC (de l’anglais “Compound Correlation Clusters”), représentant des familles de composés ayant des profils d’inhibition similaires entre les échantillons (Baccelli et al., Blood cancer J, 2017). Lorsque mise en relation avec la classification génomique des sous-groupes de LMA, cette approche met en évidence des composés ayant un potentiel thérapeutique intéressant (par exemple, des composés ciblant des sous-groupes spécifiques de LMA, des échantillons de LMA à haute fréquence en cellules souches leucémiques ou encore des échantillons de LMA associés à un mauvais pronostic: Krosl et al., Blood advances, 2021; Moison et al., Blood advances, 2019; Baccelli et al., Cancer cell, 2019; Bisaillon et al., Leukemia, 2019; Simon et al., Clinical cancer research, 2017). L’activité anti-LMA de ces composés est ensuite validée à l’aide d’approches pharmacologiques et génétiques de même qu’in vivo par des études précliniques en utilisant des modèles murins. Avec cette stratégie, nous espérons identifier et cibler les talons d’Achille des différents sous-types de leucémie myéloïde aiguë.
Caractérisation génomique des sous-groupes LMA
en collaboration avec les groupes de Josée Hébert, Vincent-Philippe Lavallée et Sébastien Lemieux
Raffiner la stratification des patients atteints de LMA est un défi d’envergure et représente un élément primordial pour améliorer le diagnostic et le traitement de la LMA. Dans le cadre du projet Leucégène, notre groupe a séquencé près de 700 échantillons primaires de LMA (ADN et /ou ARN) sélectionnés de manière à représenter la diversité génétique de cette maladie. À l’aide de ce jeu de données unique, nous développons des projets multidisciplinaires combinant -omique, biologie moléculaire et méthodes d’analyse innovantes permettant de disséquer les déterminants qui façonnent la variabilité de la LMA (par exemple : mutations, réarrangements structurels, signatures d’expression). Plus précisément, notre approche implique la comparaison des données provenant d’échantillons d’un sous-groupe génétique donné avec les résultats de séquençage des autres échantillons de la cohorte, en mettant l’accent sur des signatures d’expression/mutations comprenant un nombre limité de candidats, plutôt qu’une approche plus globale. En utilisant cette stratégie, nous avons confirmé toutes les mutations connues aux différents sous-groupes de LMA, et plus important encore, nous en avons identifié de nouvelles permettant la reclassification de certains patients (Simon et al., Blood, 2020; Lavallée et al.: Leukemia (2018), Blood (2016 (2)), Leukemia (2016), Nature Genetics (2015), Blood (2015); Lehnertz et al., Blood, 2017). En tirant parti de cet ensemble de données unique, nous visons donc à mieux caractériser les sous-groupes rares de LMA et à en identifier de nouveaux, pour ultimement proposer de nouveaux marqueurs diagnostiques et pronostiques.
Développement d’anticorps thérapeutiques pour la LMA
en collaboration avec le groupe de Philippe Roux
L’immunothérapie à base d’anticorps est une option thérapeutique attrayante, car elle produit généralement une activité anti-tumorale associée à un risque réduit de toxicité systémique en comparaison avec les thérapies plus conventionnelles. Bien que cette approche soit très prometteuse, son développement dépend inévitablement de l’identification d’antigènes de surface fiables exprimés sélectivement par les cellules cancéreuses. Historiquement, l’identification d’antigènes de surface pour les cellules tumorales est problématique en raison de l’hydrophobicité caractéristique des protéines de la membrane plasmique, entravant leur purification par des méthodes biophysiques. En outre, contrairement aux tumeurs solides, l’immunothérapie à base d’anticorps reste sous-exploitée en LMA, vraisemblablement en raison de la disponibilité limitée d’antigènes spécifiques à la LMA. Notre groupe a développé une approche combinant l’analyse du transcriptome et du protéome de surface d’échantillons primaires de LMA afin d’identifier de nouveaux antigènes pour cette maladie. Cette approche a déjà identifié plusieurs antigènes potentiels pour certains sous-groupes de LMA. Des anticorps thérapeutiques ciblant ces antigènes sont actuellement développés et testés pour leur habileté à éliminer les cellules primaires humaines de LMA en culture et éventuellement in vivo.
Développement de tests pronostiques en LMA
en collaboration avec Guillaume Richard-Carpentier et le groupe de Josée Hébert
L’équipe Leucégène travaille actuellement au développement de nouveaux tests pronostiques pour mieux orienter le traitement des patients atteints de LMA. À partir des données de séquençage de l’ARN des échantillons primaires de la cohorte Leucégène et des données cliniques de la Banque de cellules leucémiques du Québec, un premier marqueur pronostique, HMGA2, a été identifié (Marquis et al., Blood Cancer J, 2018). Un test pronostique a ensuite été développé et validé par le laboratoire préclinique de Josée Hébert à l’Hôpital Maisonneuve-Rosemont, test permettant la reclassification de patients à risque défavorable initialement classés dans la catégorie de risque intermédiaire. L’équipe Leucégène poursuit ces efforts afin d’identifier des marqueurs pronostiques additionnels afin de mieux stratifier les patients à risque intermédiaire et améliorer par le fait même le résultat des traitements.